Одна из наиболее примечательных законодательных инициатив последних месяцев — установление на уровне федерального законодательства норм, предписывающих поставщикам и продавцам фармацевтической продукции производить маркировку лекарственных средств в целях включения сведений о реализуемых на рынке позициях в специализированную информационную систему.
Изучим подробнее, в чем ее сущность и какие задачи предстоит решать поставщикам лекарств.
Вы можете узнать примерную стоимость внедрения маркировки для вашего бизнеса, ответив на несколько вопросов.
Закон об обязательной маркировке лекарственных средств с 2020 года
Согласно Федеральному закону от 28.12.2017 N 425-ФЗ закон «Об обращении лекарственных средств» от 12.04.2010 N 61-ФЗ был дополнен нормами, регламентирующими уникальную для российского рынка процедуру — мониторинг движения лекарственных средств от завода к потребителю с применением особых средств маркировки.
В статье 67 Закона появились положения, в соответствии с которыми:
- На производителей возлагается обязанность по нанесению на упаковку с лекарственным средством (либо непосредственно на емкость с фармпрепаратом) особых «средств идентификации» (ч. 4 ст. 67 вступает в силу с 1 июля 2020 года).
Характеристики таких «средств идентификации», алгоритм их нанесения на поверхности изделий и требования к содержанию должны быть установлены Правительством России.
- Правительство должно создать «систему мониторинга лекарственных препаратов», порядок ее формирования в рамках взаимодействия бизнеса и органов власти. Предполагается учреждение имеющих установленную компетенцию операторов системы мониторинга.
- На производителей и продавцов лекарств возлагается обязанность по своевременному внесению сведений о лекарствах в систему мониторинга их движения. Покупатели при этом должны иметь возможность бесплатно получать данные из системы через интернет (ч. 7 ст. 67 вступает в силу с 1 июля 2020 года).
За нарушения указанных предписаний закон устанавливает ответственность в соответствии с законом.
Указанные выше нормы в большей части вступают в силу с 1 июля 2020 года. Таким образом, у участников фармацевтического рынка есть время, чтобы подготовиться к внедрению, очевидно, крайне масштабной информационной системы.
Вместе с тем закон наделяет Правительство РФ правом устанавливать особенности внедрения системы мониторинга движения лекарственных препаратов, включая сроки. Речь идет, в первую очередь, о лекарствах, включенных в перечень жизненно необходимых, предназначенных для лечения гемофилии, муковисцидози, гипофизарного нанизма, болезни Гоше и др. Для препаратов высокозатратных нозологий обязательная маркировка началась в октябре 2019 года.
Вместе с тем, указанные предписания не стали сюрпризом для рынка. Этому поспособствовал специальный пилотный проект, нацеленный на подготовку к внедрению специализированной системы мониторинга лекарств.
Пилотный проект системы мониторинга лекарств
В январе 2017 года Правительство издало Постановление № 62, регламентирующее проведение эксперимента по мониторингу оборота лекарств, маркированных установленным способом.
Данный эксперимент был запущен в нескольких российских регионах — Москве и Московской области, Санкт-Петербурге, Белгороде, Великом Новгороде, Нижнем Новгороде. Интерес к данной системе проявил и бизнес в лице таких крупнейших брендов как «36.6», «Биокад», AstraZeneca и многих других. В проекте приняли участие также несколько десятков лечебных учреждений и несколько сотен аптек.
Эксперимент показал, как отмечают компетентные представители органов власти, работоспособность механизма мониторинга лекарств. Так, благодаря реализованным технологиям, удалось обнаружить незаконную коммерческую продажу лекарств в аптеках, в то время как данные фармпрепараты поставлялись в лечебные учреждения бесплатно.
Отслеживание движения лекарств в целях контроля над исполнением различных программ экономической поддержки медучреждений — не единственная задача, которую призвана решать новая система мониторинга.
Другая важнейшая задача — создание общедоступного механизма проверки лекарств на предмет подлинности. Рядовой потребитель, делая определенный запрос в систему перед покупкой лекарства в аптеке (или после ее совершения), должен иметь возможность установить — действительно ли в его руках фармпрепарат, выпущенный легально.
Ожидается, что благодаря средствам идентификации лекарств контрафакт с использованием рассматриваемой системы будет оперативно выявляться — как и его поставщики.
Пользователь сможет задействовать систему с помощью специального мобильного приложения. В период реализации пилотного проекта сервисом занималась ФНС.
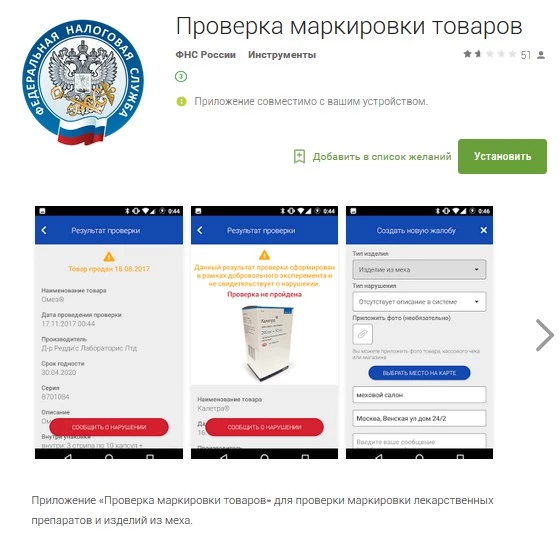
Используя смартфон, пользователь может просканировать QR-код (скорее всего, он и останется базовой технологией маркировки) на лекарстве и выяснить, легально ли произведен фармпрепарат. И если нет — уведомить об этом регулирующие органы с помощью данного приложения.
Можно отметить, что функционал приложения позволяет сейчас проверять на предмет контрафакта не только лекарства, но и продукцию из натурального меха.
По состоянию на декабрь 2017 года в пилотную систему мониторинга маркированных лекарств были внесены сведения о более чем 2,6 млн. упаковках препаратов.
Рассмотрим подробнее основные принципы работы системы мониторинга, о которой идет речь — реализованные, в частности, в рамках пилотного проекта.
Принципы функционирования системы мониторинга фармпрепаратов
Система мониторинга предполагает отслеживание движения товара по всей цепочке — от производителя до конечного потребителя.
На начальном звене соответствующей цепочки — после выпуска фармпрепарата с конвейера, на емкости (или на коробке) печатается идентификационный QR-код. Сведения о выпуске препарата заносятся в информационную систему. Уже с того момента контролирующие органы могут видеть, какие препараты были отпущены и в каком количестве.
Факт отправки лекарств продавцу также отражается в информационной системе. При приемке товара продавец регистрирует каждую позицию — также сканируя QR-код. После того как позиция отпускается конечному потребителю, в системе отражается факт выхода экземпляра лекарственного препарата из оборота.
Клиент затем может, использовав доступные информационные ресурсы (в рамках пилотного проекта — приложение), проверить — легален ли фармпрепарат. Попытки поставщика контрафактной продукции продублировать QR-код и поставить «нелегальную копию» препарата в другую аптеку, очевидно, будут быстро распознаваться системой.
Мониторинг лекарств и онлайн-кассы — есть ли взаимосвязь?
Стоит отметить, что коммуникации с участием игроков рынка онлайн-касс — продавцов товаров, ОФД, ФНС — осуществляются в рамках юрисдикции совершенно иных норм законодательства, практически не имеющих отношения к нормам, которые регулируют работу системы мониторинга лекарств. Однако, определенные аспекты взаимосвязи двух инфраструктур, вероятно, будут иметь место.
Например, органы власти, контролирующие оборот лекарств, могут при необходимости делать запросы в ФНС на предмет получения фискальных данных в подтверждение факта продажи тех или иных лекарств при расследовании прецедентов, связанных с обнаружением реализации контрафактного товара.
Совершенно не исключено появление на рынке специальных онлайн-касс, которые способны сочетать в себе основную функцию и ту, что предполагает обеспечение информационного обмена в рамках системы мониторинга лекарств (как в случае с онлайн-кассами, поддерживающими систему ЕГАИС).
Аналогично, кассовое и товароучетное ПО, используемое продавцом в целях выполнения требований Закона № 54-ФЗ, может дополняться функционалом в целях приведения деятельности фармацевтического пункта в соответствии с требованиями Закона № 61-ФЗ «Об обращении лекарственных средств».














Когда всё таки вступит в действие маркировка? ходят слухи ,что отменят или вступят в июле 2020 года.
Кто-нибудь знает?
Я уже давно кручусь в этом бизнесе и соответственно решил, что попробую ввести маркировку в качестве эксперимента. Хочу сказать, что ничего из этого продуктивного не вышло. Могу понять маркировку меховых изделий, их ненастолько большой оборот, явно что магазины с шубами не на каждом углу. А вот об аптеках такого не скажешь. Я Работаю с несколькими поставщиками и мне пришлось завести для каждого отдельный личный кабинет для оборота информации. Это жутко неудобно. Мне если введут обязательную маркировку, нужно в каждую свою аптеку, а у меня их пять в городе, сажать отдельного человека для работы именно по маркировке.
Никита, такая же история, только у нас алкоголь, и маркировка уже введена. Мы просто изготовитель и продавец в одном лице. Специально пришлось сажать специалиста. Это естественно лишние затраты, причём немаленькие, но об этом мало кто думает…
Никита, у медицинской отрасли и так предостаточно льгот от государства. Я считаю, что маркировка помогает упорядочивать все поступления и отслеживать четко обороты. Да, дополнительные сотрудники нужны, но не обязательно сажать их в каждый пункт, можно объединить несколько в 1 и над ними уже поставить человека. А вообще маркировкой еще должны заниматься при поступлении на склады, если уж у вас сеть.